RNA作為遺傳物質的傳遞者,參與細胞生命的整個過程🛠,與多種重大疾病的發生和發展密切相關。RNA示蹤是RNA研究的前提🧔🏼♀️,在RNA研究領域🩰,開發能夠在活細胞層面使用的RNA成像技術一直是所有研究人員共同追求的目標🦦。其中,熒光成像技術由於其非物理接觸🦪、實時原位的技術優勢,成為當前RNA研究最重要的手段。盡管針對蛋白的熒光成像技術已經相當成熟,並於2008年獲得諾貝爾化學獎,但是這些技術卻無法直接復刻用於RNA成像。究其原因🚆,RNA本身結構較小,不穩定,而且表達豐度低,對成像所需時間、信噪比以及探針大小都提出了極為苛刻的要求👈🏼。因此,目前能夠在活細胞層面對RNA進行成像的技術屈指可數🧍♀️,並造成RNA相互作用🧉、功能的研究舉步維艱。

RNA擁有復雜的空間分布和動態軌跡👨🏼🎨,與多種生物分子存在相互作用,並通過這些相互作用發揮其功能🧕🏽。研究RNA功能通常需要將這些動態變化以及相互作用通過熒光信號進行動態顯示,因此多目標分子同步的熒光成像🕍,即多色成像,對於RNA研究尤為重要。從熒光染料設計的角度看💢,多色成像要求各染料分子的發射光譜完全分離🍒,避免因光譜重疊帶來信號幹擾👩🏻⚖️🤶🏿。然而𓀓,當前用於RNA成像的熒光染料大多處於藍綠光區域⬜️,發射光譜嚴重重疊👩🏿🎤,無法滿足多色成像的需求🏋🏼。解決問題的關鍵在於染料光譜設計:如何在有限的可見光光譜範圍內布置多個發射光譜不重疊的熒光染料👩🏼🌾。考慮現有染料藍綠光的發射光譜,設計染料的激發譜應當與現有染料重疊🫕,而發射譜應盡可能紅移以避免與現有染料譜圖重疊🧑🏻🚀。簡而言之,需要增加染料的激發光譜和發射光譜間距(斯托克斯位移)。
從譜圖原理分析,染料分子在基態吸收光子後躍遷到激發態(S1)🤙🏽,經過一系列的能量耗散後,再從一個低能激發態(Stran)以熒光發射的方式回到基態。增加染料的激發光譜和發射光譜間距🙍🏻♀️😤,實質上就是增加S1和Stran之間的能量差🐪💪🏽,也就是在發射熒光之前,如何通過非輻射的方式盡可能多地消耗激發態能量。通過研究團隊發現,增加染料分子結構的轉動能力👆,能夠增加分子在激發態的構象數量,進而增加分子激發態的非輻射能量耗散📅。基於這一發現🚑🧕🏻,團隊在原創的分子轉子型染料的骨架結構上,引入更多的轉動位點🍵🕵🏿♂️,從而使得染料的發射光譜大幅度紅移,斯托克斯位移顯著增加,最高可達108 nm👨🎨,高出傳統熒光染料至少4倍。
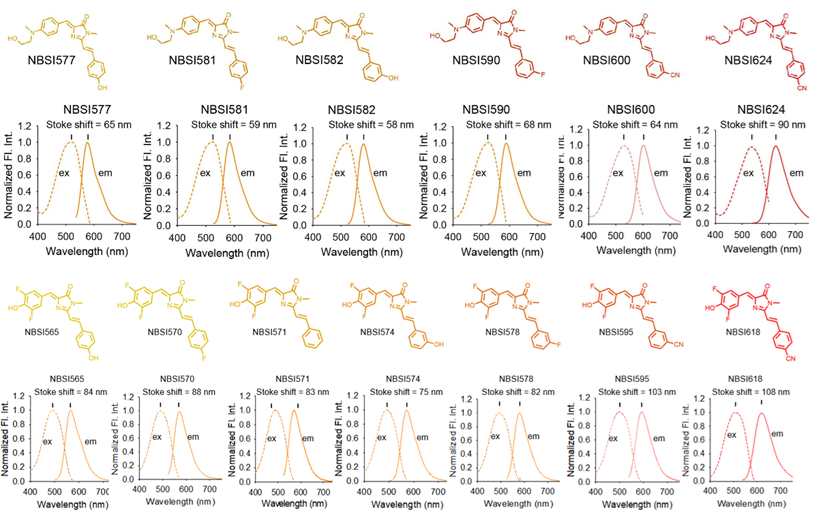
圖1 具有大斯托克斯位移熒光染料的化學結構及其激發發射光譜
基於該類染料與現有染料發射光譜的顯著區別🖐🏽,因此能夠與現有熒光技術聯合使用,用於多個RNA分子的實時熒光追蹤。值得指出的是,該類染料沿襲了分子轉子型結構設計帶來的優勢,具有高信噪比、快速成像特點🖖🏼;同時,該類染料與前期研發的分子轉子型熒光染料在激發光譜上重疊,但在發射光譜上顯著區分,二者發射光譜間距高達100 nm。研究團隊基於這兩類染料的聯合使用,成功在活細胞中實現了多個RNA分子的同時監測👨🏻🍳。基於RNA的堿基互補配對,該技術能夠進一步實現對基因位點的多色成像研究。不僅如此,通過熒光強度與基因拷貝數的正比關系,團隊建立了活細胞中基因端粒拷貝數的定量方法🙎🏿♀️,推動活細胞層面染色體功能和空間結構的研究🧑🏽⚖️。
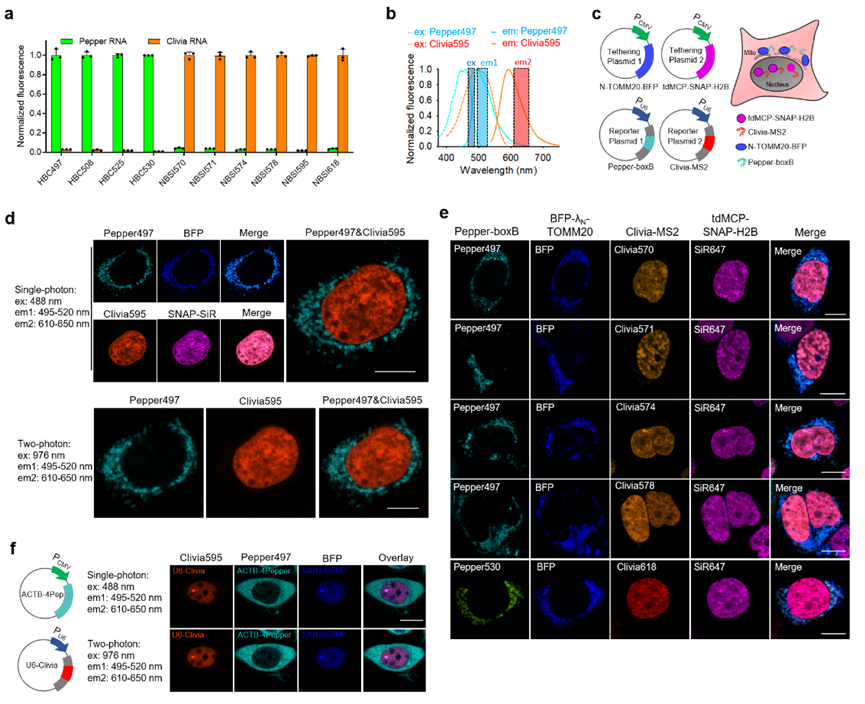
圖2 兩個熒光RNA聯合用於活細胞RNA的多色成像
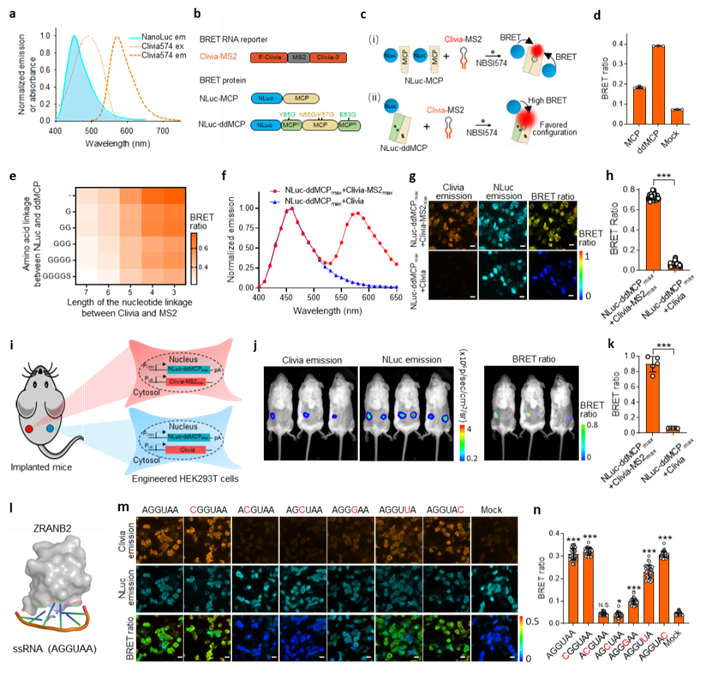
圖3構建生物發光能量轉移體系用於活細胞/活體中蛋白質和RNA相互作用的動態
關於團隊
朱麟勇教授團隊一直聚焦於生物醫用材料的研發,利用“光” 的可視與可控的獨特優勢,在 “光化學方法構建生物醫用材料”方向的研究形成了鮮明特色。在熒光探針方向,開發了一系列分子轉子型熒光染料,光譜範圍覆蓋整個可見光譜,並延伸至近紅外,為蛋白、RNA在活細胞乃至活體的熒光成像提供了不可或缺的可視化工具(Nature Biotechnology, 2019, 37, 1287; Cell Discovery, 2023, 9, 56🤖;Nature Chemical Biology, 2021, 17, 1289)。在“光化學方法構建生物醫用材料”方向,提出並發展“光偶聯反應”原位凝膠技術🧑🏿🚒,實施高機械強度與強組織粘附的水凝膠生物材料的超快構建,並由此推動醫用光敏生物膠產品的臨床轉化(Nature Materials, 2023, https://doi.org/10.1038/s41563-023-01648-4; Nature Communications, 2019, 10, 2060; Advanced Materials, 2021, 2, 2105667; Science Advances, 2021, 7, eabg0628; Nature Communications, 2021, 12, 1670)。