
多酶復合物中酶之間的空間和時間排列和組合在代謝調控中非常重要♦️,對多酶體系進行空間🤥、距離和組合的調節可實現對代謝物的高效可編程調控🚗。受自然界的啟發,人工蛋白質和DNA支架已被以可控的方式用於共定位酶,以增強代謝反應🙋🏿。然而,這些方法仍然很難實現動態調節👱♀️🕦。
近年來,可編程DNA納米技術被廣泛應用於酶級聯體系並實現了在酶級聯動態調控中的應用🕡。例如DNA納米鑷子可以有效地控製雙酶之間的距離;基於DNA鏈置換的酶級聯反應實現了活體內酶級聯活性的調控,有效地調節了代謝物在活體內合成的效率🫵。然而在更復雜的體內環境中,代謝物的合成和調控並不局限在雙酶體系中,多種酶組成的復雜代謝組學調控變的尤其重要,但對多種代謝物動態按需檢測目前仍是難題。
近日🏆,意昂4平台宋萍副教授和左小磊教授合作,以可編程DNA納米技術為基礎提出了新型酶級聯體系設計策略🗳,構建了DNA和酶的超分子結構(a super DNA-enzymes molecules,SDEM)),實現了多酶催化性能的可編程調控👩🏽✈️,大大提高了檢測靈敏度🤾🏻♀️。
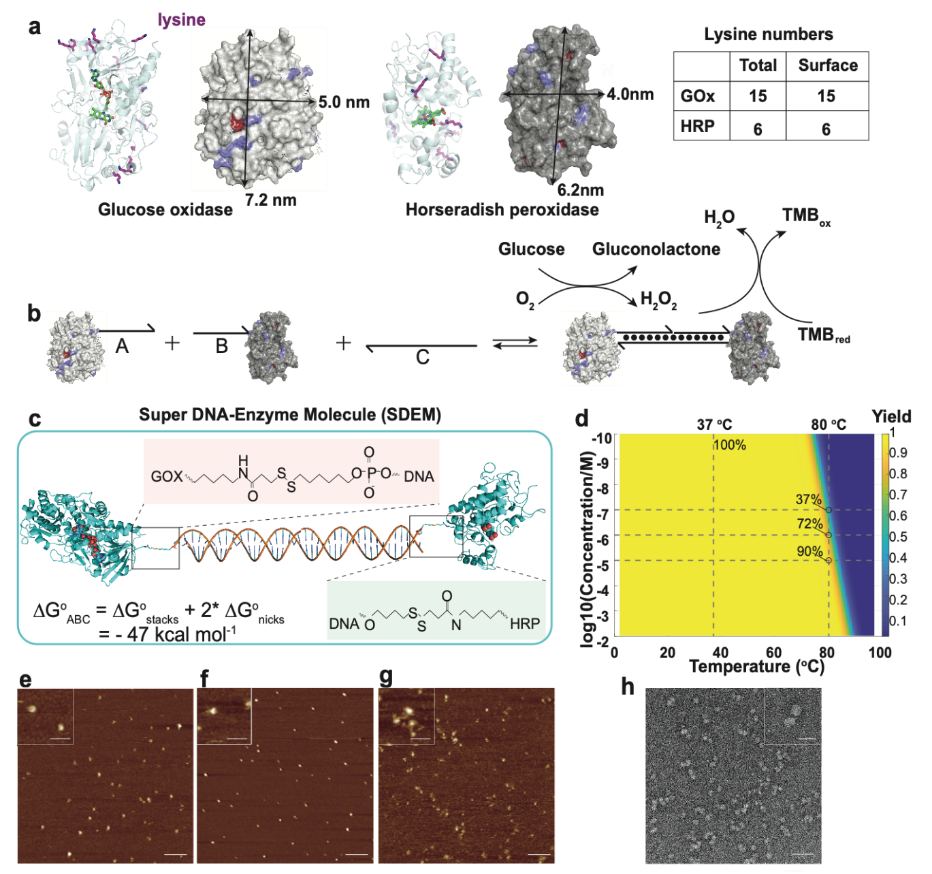
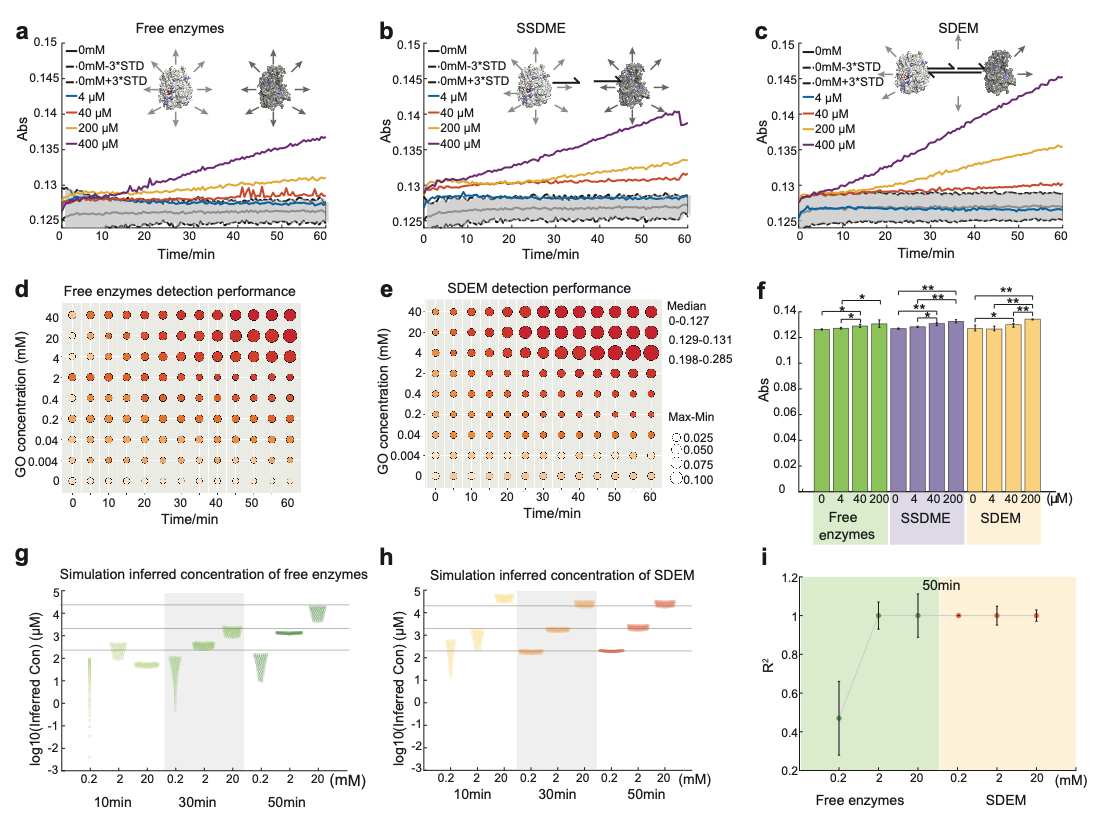
構建的SDEM超分子結構有效地增加了DNA在調控酶級聯體系中的可編程性🍩。同時相比於遊離的酶,SDEM超分子結構構建的酶級聯在對靶標的檢測靈敏度和準確性中更具有優勢,通過計算模擬和酶級聯催化實驗得到驗證🌼🛞。由葡萄糖氧化酶(GOx)和辣根過氧化物酶(HRP)組成的可編程SDEM的檢測限比遊離酶低20倍且反應速率提高了1.6倍👩🍳。
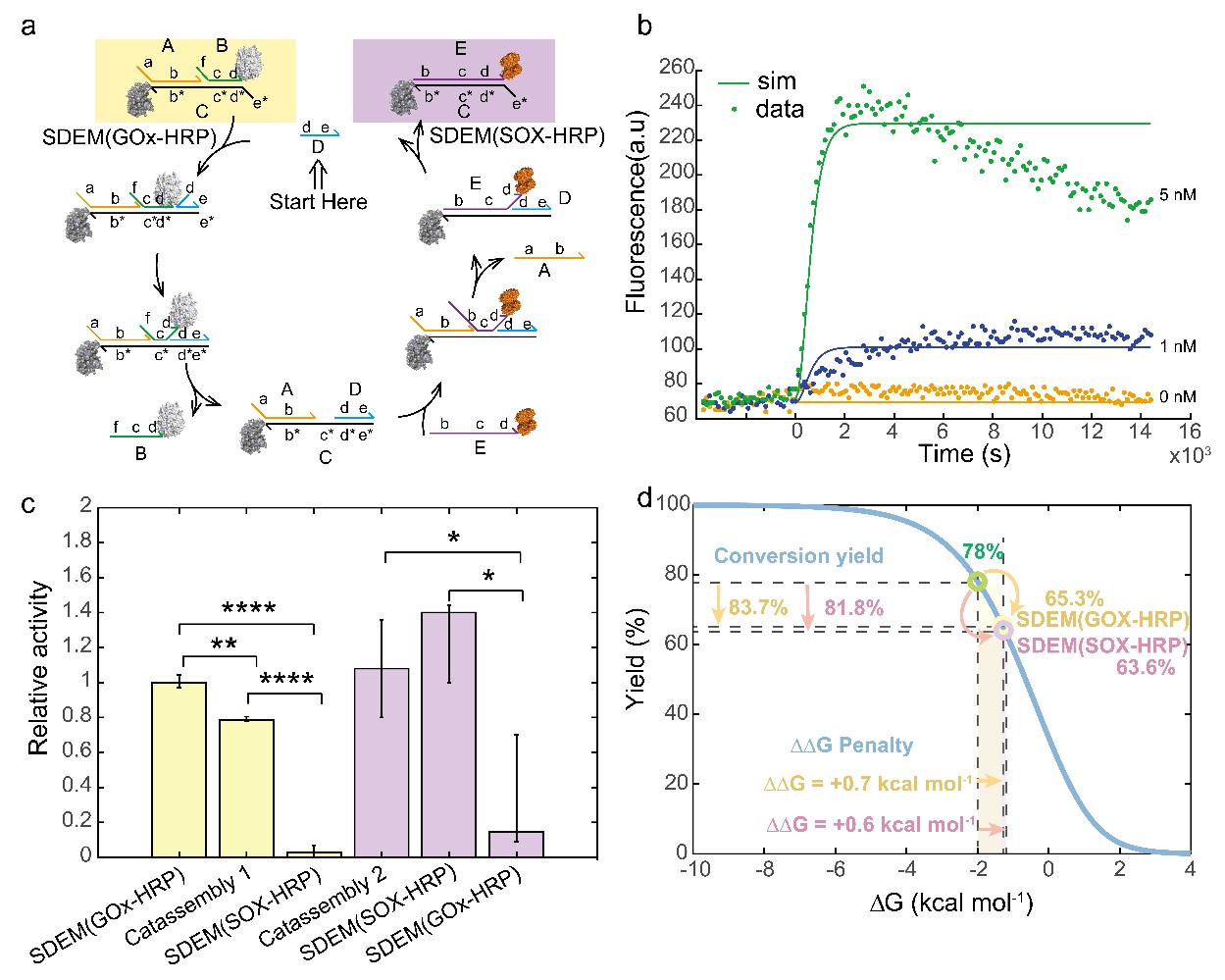
該體系不僅可以實現酶級聯體系的循環調控👀,而且可以通過添加DNA催化鏈實現SDEM分子的催組裝,使得一個SDEM超分子結構被催化成另一個新的SDEM超分子結構♒️。該反應是基於DNA催化的熵驅動反應🧎🏻➡️,該反應簡單👳🏿、快速、可模塊化、可組合且穩定🆕。在該反應體系中熵反應的產率與直接退火反應的產率一樣高🎓。計算結果表明相比於沒有催化鏈的條件下🧩🥗,DNA催化鏈介導的熵驅動反應體系中反應速率提高了六個數量級。在低濃度酶的活體環境中🏢,我們的工作為通過現有酶級聯體系構建新的酶級聯體系提供了一種新的思路,有望實現針對不同代謝物的按需檢測👩🏼🎨。
研究成果
“Programming Super DNA-Enzyme Molecules for On-Demand Enzyme Activity Modulation”近期發表在《Angewandte Chemie International Edition》(2023)♘,論文的第一作者為意昂4平台化學化工意昂4博士生趙海培😩,由附屬仁濟醫院分子醫學研究院左小磊教授團隊和意昂4体育平台宋萍副教授團隊合作完成,並在催組裝理念與設計上得到了田中群院士和樊春海院士的指導。
Angewandte Chemie International Edition
DOI🕵🏽♀️🧙🏼♂️:doi.org/10.1002/anie.202214450
供稿單位:核酸生物醫學工程課題組
作者:趙海培
審核:宋萍🖍、丁顯廷
