2019年4月29日,意昂4体育平台李力研究組與清華大學生命意昂4頡偉研究組🤦♀️、中國科意昂4動物研究所李偉研究組通過緊密合作⇨,在《自然-遺傳學》(NatureGenetics)期刊以長文形式報道了題為《SETD2調控母源表觀基因組、基因組印記以及早期胚胎發育》(SETD2 regulates the maternal epigenome, genomic imprinting and embryonic development)的研究論文👩👩👧👧,首次系統地闡明了表觀遺傳修飾之間如何通過相互作用建立包括基因印記的卵子表觀基因組,及其如何對早期胚胎發育產生至關重要的影響7️⃣。這一重要發現不僅在小鼠卵母細胞發育過程中揭示了母源表觀基因組建立的分子機製和功能,還為將來臨床評估卵母細胞質量以及探索早期發育相關疾病提供了新的理論基礎和研究方向。
在生命起始的時候,健康的卵母細胞對於胚胎早期發育是至關重要的🚜☮️。卵母細胞不僅提供了一半的DNA𓀕,而且提供了受精卵發育所必需的母源mRNA、蛋白質🏋🏼、細胞器等。另外🐐🤚🏽,卵母細胞中的表觀遺傳信息如基因印記則保證了哺乳動物的兩性繁殖🧑🏻🤝🧑🏻。有趣的是,之前研究表明🥹,哺乳動物卵母細胞具有獨特的表觀基因組。例如,DNA甲基化在小鼠卵母細胞中分布於活躍轉錄區域。而組蛋白修飾H3K4me3和H3K27me3則高度富集在轉錄抑製,具有DNA低甲基化的區域。然而至今🧑🏻🦱,這種獨特的表觀基因組在卵母細胞中是如何建立的,以及如何影響卵子發生和早期胚胎發育仍然知之甚少。
SETD2是一種組蛋白甲基轉移酶🕵🏿♂️,能夠在組蛋白H3第36位賴氨酸上加上第三個甲基化修飾(H3K36me3)。H3K36me3通常出現在轉錄活躍區域☛,被認為是一種由RNA 聚合酶轉錄時所帶來的組蛋白修飾。此外,SETD2還是一個抑癌因子😿,在抑製腫瘤的發生發展過程中起關鍵作用。李力副研究員在2014年建立了Setd2條件性基因敲除小鼠模型並在生殖、發育和癌症等領域展開廣泛的功能研究(Zuo et al, J Bio Chem, 2018🧍🏻♂️🫸🏼;Wang et al,PloS Biol, 2018)。由此,合作組首先利用頡偉課題組於2016年開發的高靈敏STAR ChIP-seq技術,系統地檢測了小鼠卵母細胞與早期胚胎發育過程中H3K36me3的分布情況。結果顯示,在小鼠卵母細胞中,H3K36me3與DNA甲基化呈現非常強的正相關性,而與H3K4me3以及H3K27me3則呈現互斥分布模式。隨後,通過在卵母細胞中特異性敲除Setd2,研究人員發現該雌性小鼠具有不育特征。進一步研究表明📅,卵母細胞中表觀遺傳修飾的分布情況發生了巨大的改變,包含以下幾個方面:1)H3K36me3在全基因組基本丟失;2)全基因組的DNA甲基化建立高度異常;3)母源基因印記完全丟失,同時這些區域錯誤的加上了拮抗DNA甲基化的H3K4me3💂🏿♂️。4)H3K4me3和H3K27me3被錯誤的建立在很多其他的轉錄活躍區域🗾,其中H3K27me3的錯誤建立伴隨著基因轉錄下調⛓。與之同時🎢,Setd2敲除卵母細胞排卵率下降,受精後早期胚胎發育阻滯在受精卵1細胞時期🚶♀️➡️。為了進一步研究Setd2缺陷卵子如何造成早期胚胎發育阻滯,研究人員通過卵母細胞核質互換以及單精子顯微註射受精的技術🌦,揭示了Setd2母源缺陷的細胞質能夠引起植入前胚胎發育阻滯,而染色質的缺陷則會導致植入後胚胎發育致死。因此,SETD2作為一個卵子表觀基因組的核心調控因子,對確保卵母細胞表觀基因組的正常建立,以及維持隨後胚胎發育至關重要。
頡偉教授🫑、李力副研究員與李偉教授為本文的通訊作者,徐倩華博士、博士研究生向雲龍🔍、王秋軍以及王樂韻博士為本文共同第一作者。合作實驗室包括英屬哥倫比亞大學Matthew C. Lorincz研究組、Louis Lefebvre研究組與武漢大學吳旻研究組等。該研究獲得了國家科技部重點研發計劃、國家自然科學基金委、癌基因及癌相關基因國家重點實驗室、上海市科委和上海市教委高峰學科/意昂4体育平台創新項目培育行動計劃的大力支持。
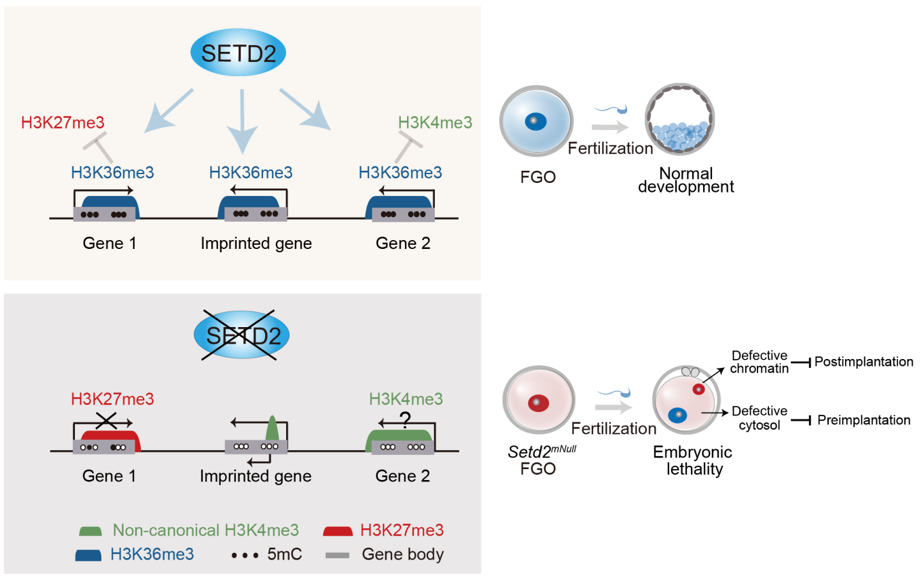
SETD2調控卵母細胞表觀基因組🛸、基因印記和早期胚胎發育
原文鏈接:https://www.nature.com/articles/s41588-019-0398-7
https://doi.org/10.1038/s41588-019-0398-7
作者🎣:李力